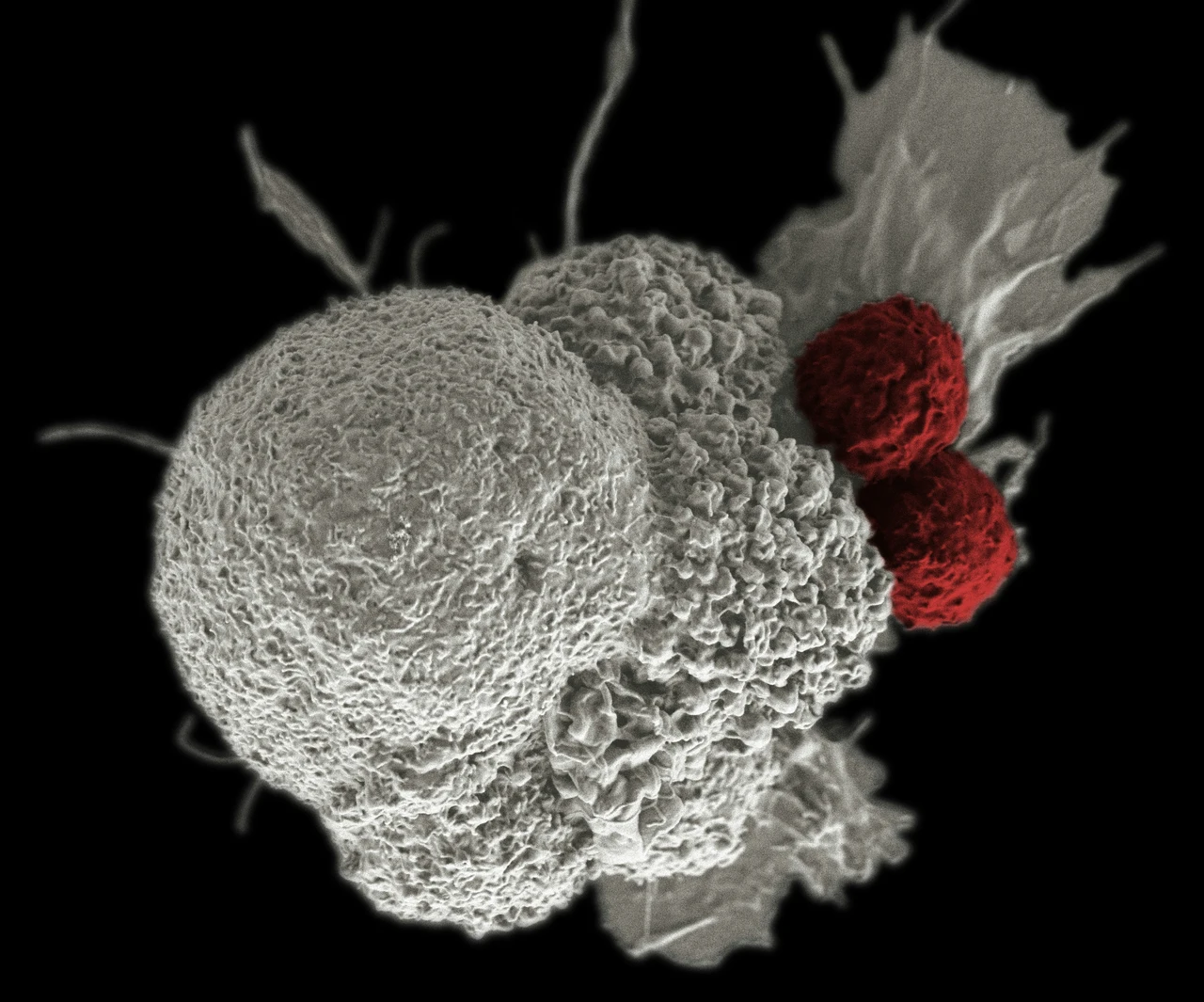
Le metastasi rappresentano una delle sfide più complesse e temute nella gestione clinica del cancro, essendo il principale fattore che determina la prognosi e la mortalità dei pazienti oncologici. Si tratta di un processo biologico, in cui le cellule tumorali, originate dal focolaio primario, acquisiscono caratteristiche tali da renderle capaci di migrarsi e insediarsi in tessuti e organi diversi da quello d’origine. Questa dinamica è alla base della gravità associata ai tumori maligni e della necessità di sviluppare terapie sempre più mirate ed efficaci.
La natura delle metastasi: definizione e importanza clinica
In ambito oncologico, quando si parla di metastasi si intende una diffusione del tumore al di fuori del sito dove ha avuto origine, con la formazione di focolai secondari in altre parti del corpo. Il termine deriva dal greco e significa letteralmente “trasferimento a distanza”. Questo fenomeno è tipico dei tumori maligni, mentre non riguarda quelli benigni. Il processo metastatico è responsabile di circa il 90% dei decessi oncologici, secondo le principali stime, anche se il dato è ancora oggetto di dibattito nella comunità scientifica .
Le metastasi rivelano spesso l’avanzamento più grave della malattia e, in molti casi, la presenza di focolai metastatici indica una fase in cui le opzioni terapeutiche diventano più limitate e orientate al controllo del tumore più che alla cura definitiva. In clinica, la loro identificazione influenza profondamente la pianificazione dei trattamenti e il percorso diagnostico del paziente.
Meccanismi molecolari e cellulari della formazione metastatica
Il processo di metastatizzazione è reso possibile da una serie di mutazioni genetiche e alterazioni epigenetiche che conferiscono alle cellule tumorali capacità di:
- Distaccarsi dalla massa tumorale primaria;
- Migrare attraverso i tessuti circostanti;
- Penetrare nei vasi sanguigni o linfatici;
- Circolare nel sistema vascolare fino a raggiungere siti distanti;
- Adattarsi e proliferare in un nuovo microambiente, formando una colonia tumorale secondaria.
Gran parte delle cellule che tentano questo percorso va incontro a morte per via della selezione ambientale e delle difese immunitarie. Solo poche riescono a sopravvivere e a formare una massa tumorale secondaria . Le metastasi, nella maggior parte dei casi, presentano caratteristiche morfologiche e mutazioni genetiche simili al tumore primario, sebbene possano acquisire nuovi profili di resistenza ai trattamenti.
Gli studi più recenti hanno approfondito il ruolo cruciale di specifiche proteine regolatorie nel processo di disseminazione metastatica. Due di queste, identificate come SP1 e KLF5, svolgono funzioni opposte: SP1 agisce da acceleratore favorendo l’invasione dei tessuti da parte delle cellule tumorali, mentre KLF5 ne frena la diffusione . La complessa interazione tra geni, proteine e microambiente tumorale porta alla formazione di un impronta genica tipica delle cellule metastatiche, utile anche ai fini diagnostici.
Fattori di rischio e diagnosi della malattia metastatica
La predisposizione alle metastasi varia notevolmente in base al tipo di tumore. Tumori come quello della mammella, del polmone, del colon e della prostata sono particolarmente noti per la loro tendenza a formare metastasi, spesso in siti specifici come fegato, polmoni, ossa e cervello. Tra i fattori che favoriscono la diffusione metastatica vi sono:
- Grado di aggressività del tumore primario;
- Presenza di alterazioni genetiche specifiche;
- Stato del sistema immunitario del paziente;
- Caratteristiche del tessuto circostante e degli organi bersaglio.
Per la diagnosi precoce delle metastasi, oltre agli esami di imaging (come TAC, PET e risonanza magnetica), negli ultimi anni si è diffuso l’utilizzo della biopsia liquida. Questa tecnica consente di identificare, attraverso un semplice prelievo di sangue, la presenza di cellule tumorali circolanti o frammenti di DNA tumorale, fornendo informazioni preziose sul profilo genetico del tumore e lo stato evolutivo della malattia .
Nuove frontiere terapeutiche contro le metastasi
Fino a pochi decenni fa, la terapia delle metastasi era prevalentemente di tipo palliativo, basata su chemioterapia, radioterapia e in alcuni casi chirurgia. Oggi, grazie ai progressi della ricerca, si stanno affermando strategie innovative che puntano a colpire i meccanismi specifici della diffusione metastatica.
Terapie mirate e immunoterapia
Le terapie mirate agiscono su specifici bersagli molecolari presenti sulle cellule metastatiche, come i recettori o le mutazioni genetiche alterate. Questo approccio, più selettivo rispetto alla chemioterapia tradizionale, consente di bloccare la crescita e la migrazione delle cellule tumorali limitando gli effetti collaterali.
L’immunoterapia, invece, stimola le difese naturali del corpo affinché individuino e distruggano con maggiore efficacia le cellule metastatiche. Nuove classi di farmaci, come gli inibitori dei checkpoint immunitari, si sono già dimostrate efficaci nel trattamento di diversi tumori in fase metastatica, aumentando la sopravvivenza dei pazienti .
Ricerca genetica e medicina personalizzata
La decodifica dei profili genetici delle cellule metastatiche ha aperto la strada alla medicina di precisione. Attraverso l’analisi del DNA tumorale, è possibile identificare le mutazioni responsabili della resistenza ai trattamenti e proporre combinazioni terapeutiche su misura per ciascun paziente. La biopsia liquida rappresenta uno strumento fondamentale in questo contesto, permettendo di monitorare l’evoluzione molecolare del tumore nel tempo e di adattare la terapia in modo tempestivo.
Nuove strategie sperimentali
Tra le frontiere emergenti, si segnalano lo sviluppo di nanoparticelle in grado di veicolare farmaci direttamente nella sede metastatica e l’esplorazione di farmaci che interferiscono con il microambiente specifico che favorisce la sopravvivenza e la proliferazione delle cellule tumorali a distanza. Sono attivi anche studi su terapie cellulari avanzate, come i linfociti CAR-T, e su nuove molecole mirate a contrastare le prime fasi della disseminazione tumorale.
L’evoluzione delle conoscenze sulle metastasi sta rimodellando profondamente la pratica oncologica. Se da un lato la sfida resta impegnativa per la complessità dei meccanismi biologici coinvolti e la capacità adattativa delle cellule tumorali, dall’altro le nuove tecnologie e l’approccio multidisciplinare stanno aprendo prospettive inedite. La scommessa per il futuro è comprendere sempre meglio i segnali e le interazioni molecolari che permettono la disseminazione tumorale, per intervenire in modo sempre più precoce, personalizzato ed efficace.